吴照球团队在Nature子刊Nature Communications报道锌指转录因子ZEB1在乳腺癌发生发展中的新机制
2019年7月19日,我校基础医学与临床药学学院吴照球教授团队在Nature子刊Nature Communications(Nature Index收录,2019年IF为11.878)上发表题为“A ZEB1/p53 signaling axis in stromal fibroblasts promotes mammary epithelial tumours”的研究论文。课题组成员傅蓉副教授、韩辰凤硕士、倪婷博士和邸磊博士为本文的共同第一作者,吴照球教授为唯一通讯作者。本项工作同时受到基础医学与临床药学学院院长郭青龙教授的大力支持。
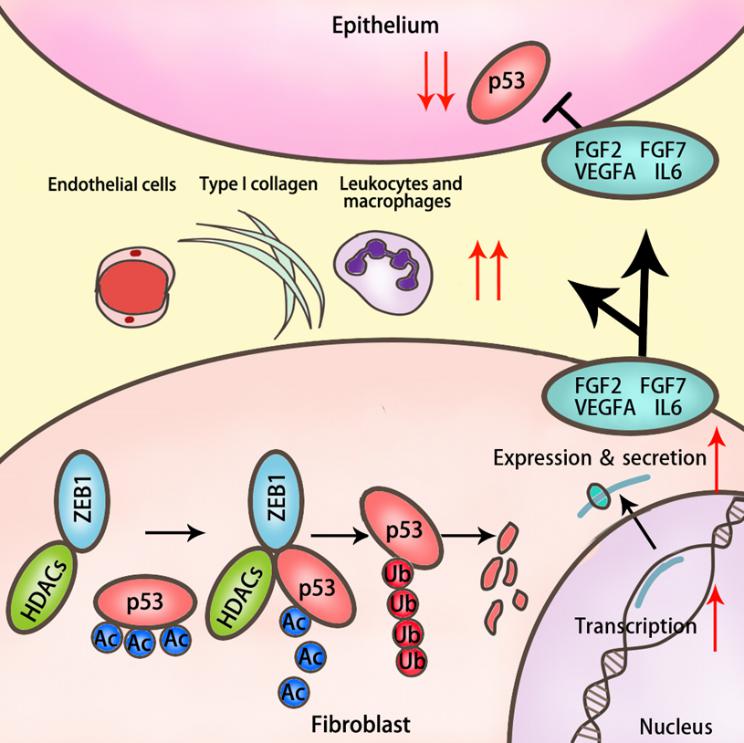
越来越多的研究结果表明,肿瘤微环境对多种恶性肿瘤的发生、发展、侵袭与转移以及肿瘤耐药有着重要影响。肿瘤微环境由多种基质细胞、胞外基质、细胞因子/趋化因子等组成。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)被认为是最主要也是功能最重要的肿瘤微环境基质细胞。CAFs通过分泌生长因子、促血管生成及免疫反应趋化因子等经旁分泌途径作用于肿瘤细胞,或者通过募集其他基质细胞如巨噬细胞、内皮细胞,血管周细胞等,促进肿瘤细胞的增殖、血管生成、肿瘤细胞的转移和扩散,并参与肿瘤耐药的形成。
吴照球团队首次报道锌指转录因子ZEB1特异性的在包括乳腺癌在内的多种肿瘤的基质中高表达,而在肿瘤细胞中不(或低)表达。在对100多个乳腺癌病理样本染色以及利用TCGA数据库的分析后发现,乳腺癌基质中ZEB1的表达水平升高与总生成率和无复发生存率呈现负相关性。随后,课题组构建的ZEB1组织特异性敲除、自发性恶性乳腺癌转基因动物模型,研究发现条件性敲除基质成纤维细胞中ZEB1基因,小鼠乳腺肿瘤的发生,进展和转移都得到了抑制,同时显著延长了小鼠生存期。后续的研究发现ZEB1可以调控p53信号轴,从而影响下游基因的表达,对肿瘤微环境有着重要的影响。
该研究工作发现了肿瘤基质成纤维细胞特异性的ZEB1/p53信号轴在肿瘤发生、发展及转移中的关键作用,抑制ZEB1或者ZEB1/p53相互作用或许可以成为新的药物设计和研发策略。
该工作受到了国家自然科学基金、江苏省自然科学基金“杰出青年”项目及青年项目、江苏省“双创”计划、学校“双一流”创新团队项目、国重实验室自主创新项目等的资助。
(供稿单位:基础医学与临床药学院,撰写人:何聿娴)
