姚静团队在Nano Letters报道Gemini-like纳米药物用于肿瘤血管重塑与微环境调控的最新研究成果
近日,材料学领域权威期刊Nano Letters(影响因子 12.279)在线发表了我校药学院姚静教授团队的最新研究成果——Self-Propelled Gemini-like LMWH-Scaffold Nanodrugs for Overall Tumor Microenvironment Manipulation via Macrophage Reprogramming and Vessel Normalization(https://doi.org/10.1021/acs.nanolett.9b04024)。已毕业硕士研究生徐程为本文的第一作者,姚静教授为本文的通讯作者。
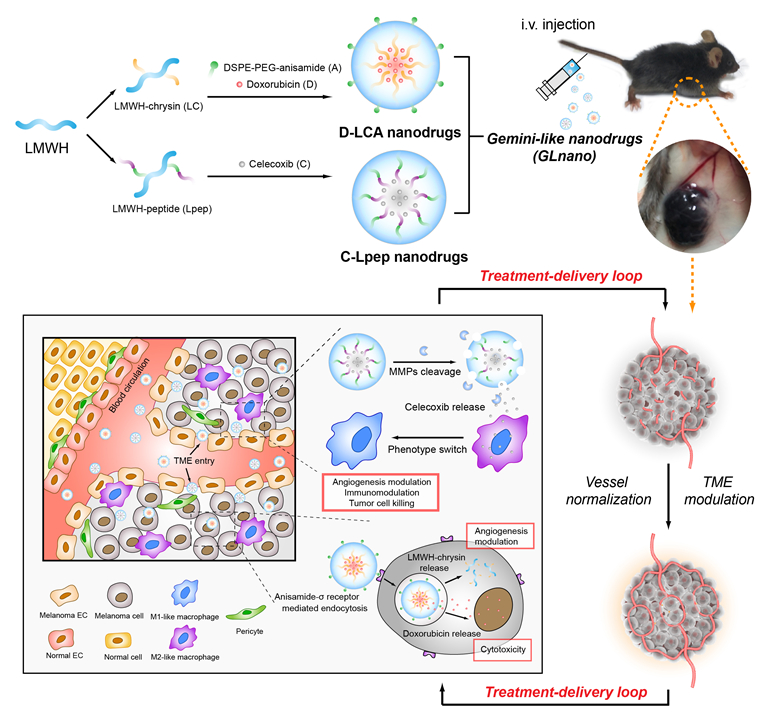
黑色素瘤是一种临床上致死率极高的皮肤肿瘤,其快速进展与肿瘤微环境密切相关。黑色素瘤的生长极大依赖微血管供应血流,然而,过量的促血管生长因子适得其反,引起微血管结构和功能缺陷,进而导致纳米药物难以向肿瘤深部递送及发挥最佳治疗作用。肿瘤血管正常化理论指出,利用抗血管生成药物恢复微环境中的抗血管因子与促血管因子水平,可使血管结构和功能得到恢复。然而,该理论在实际应用中仍有很大的局限性,如启动时间长、维持时间短、正常化程度低等。
为解决上述突出问题,该团队设计了两种“形如一体”但“独具功能”的纳米体系(即C-Lpep和D-LCA),两者并称为Gemini-like nanodrugs(GLnano)。GLnano在血液循环中具有相似的稳定性和肿瘤分布特性(“形如一体”);而进入微环境后,C-Lpep体系经基质金属蛋白酶触发解组装,释放促巨噬细胞转型药物塞来昔布进入巨噬细胞诱导表型转化;而D-LCA体系则基于σ受体介导的靶向作用进入肿瘤细胞,发挥直接杀伤作用(“独具功能”)。研究表明,GLnano能有效缩短正常化启动时间、延长正常化时间窗以及实现高水平正常化,显著改善了缺氧和免疫抑制态势。同时,纳米体系借助正常化的肿瘤血管,促进自身进入肿瘤深部,以此形成“自驱动”式“治疗-递送”正反馈体系,实现微环境总体改善,显著提高抗肿瘤治疗效果。同时,相比于常规的“All-in-one”纳米体系,本研究巧妙地将多种治疗机制的药物分散到两种特性一致的纳米体系中(“All-in-twin”),极大地降低了纳米体系的构建难度,具有较好的临床应用与工业生产潜力。
(供稿单位:药学院、科学技术处,撰写人:徐程)
